弥漫大B细胞淋巴瘤(DLBCL)是最常见的恶性B细胞非霍奇金淋巴瘤(NHL)类型,其中生发中心B细胞样(GCB-DLBCL)约占所有DLBCL病例的50%。尽管现有治疗方案(如R-CHOP)对部分患者有效,但约30%~40%的患者会出现复发或难治性疾病,导致高死亡率。近年来,肿瘤微环境(TME)在肿瘤发生、发展和耐药性中的作用备受关注。作为TME的重要组成部分,基质细胞与肿瘤细胞间的互作具体机制尚不十分清晰。
近日,广医-广州生物院联合生科院张笑人团队在Molecular Therapy期刊发表了一篇题为Interaction between stromal cells and tumor cells promotes the GCB-DLBCL cell survival via CD40/RANK-KDM6B-NF-κB axis的研究论文。该研究揭示了基质细胞与肿瘤细胞之间的相互作用通过CD40/RANK-KDM6B-NF-κB轴促进GCB-DLBCL肿瘤细胞存活的分子机制,为GCB-DLBCL提供了新的潜在的治疗靶点。

研究团队通过建立GCB-DLBCL患者来源的异种移植(PDX)模型,结合体外基质细胞-肿瘤细胞共培养系统和临床样本分析,揭示了基质细胞与肿瘤细胞之间的相互作用机制。研究发现基质细胞通过表达CD40配体(CD40L)激活肿瘤细胞中的CD40通路,上调肿瘤细胞表达的RANK配体(RANKL)。肿瘤细胞表达的RANKL进一步激活基质细胞中RANK信号,上调CD40L和BAFF的表达,两者进一步保护肿瘤细胞免于凋亡,形成CD40/RANK通路介导的正反馈环路,从而促进肿瘤细胞存活。
此外,研究首次发现CD40通路的激活上调了赖氨酸特异性去甲基酶KDM6B的表达,KDM6B通过与CD40通路协同促进NF-κB信号通路的转录活性,进一步增强了肿瘤细胞的存活能力。这一机制在B细胞中尚未被报道,为GCB-DLBCL的肿瘤微环境研究提供了新的视角。
实验验证与临床意义
研究团队通过多种实验手段全面验证了这一机制,包括流式细胞术分析、RNA测序(RNA-seq)、蛋白质免疫印迹(Western Blot)、免疫组织化学(IHC)以及染色质免疫沉淀(ChIP)实验和ChIP-qPCR等实验方法。结果表明,KDM6B介导的H3K27me3去甲基化在RELA和RELB基因启动子处的调控对NF-κB信号通路的激活至关重要。此外,CD40通路通过KDM6B促进BCL2、MCL1、CMYC和CCND2等促癌相关基因的表达,揭示了基质细胞赋予GCB-DLBCL的一种独特的致癌机制。
研究团队通过临床数据与公共数据库分析进一步支持了这一发现。通过对48例GCB-DLBCL患者的组织样本进行分析,验证了基质细胞与肿瘤细胞的互作机制涉及CD40/RANK通路的互作。通过公共数据库分析发现CD40与RANKL的高表达与患者不良预后显著相关,并且CD40通路与NF-κB信号通路及KDM6B表达呈正相关,进一步验证了CD40/RANK-KDM6B-NF-κB轴在GCB-DLBCL中的重要性。
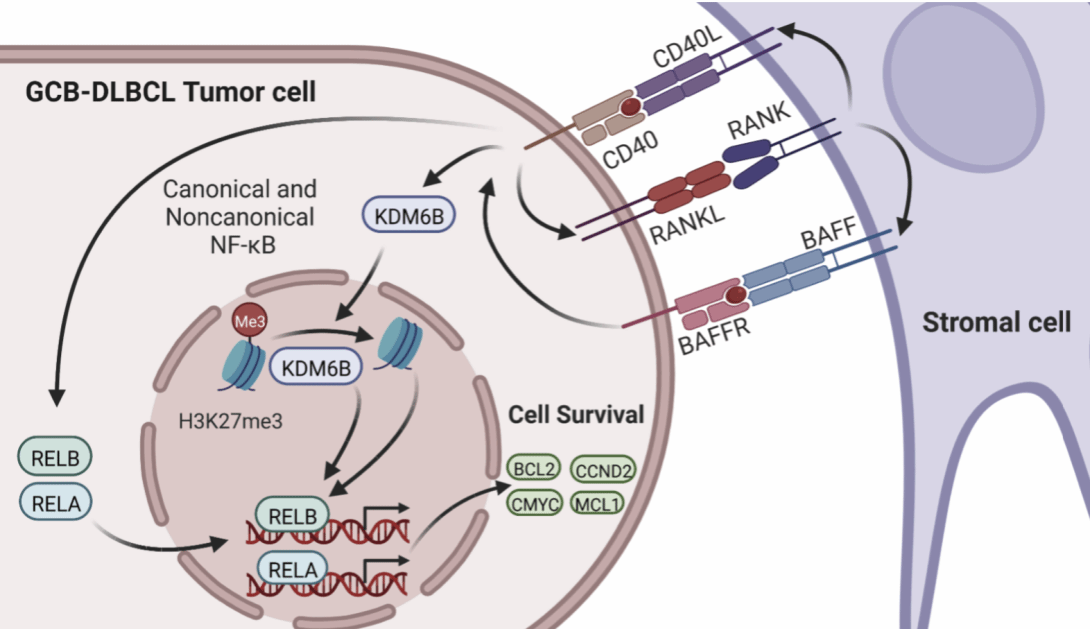
基于这些发现,研究团队提出了CD40/RANK-KDM6B-NF-κB轴作为GCB-DLBCL治疗的潜在靶点。通过靶向这一轴,未来有望开发出针对GCB-DLBCL的新型治疗策略,特别是针对治疗耐药性和复发的患者。研究团队还发现,抑制BCL2或CMYC能够显著减少肿瘤细胞的存活,这为联合靶向治疗提供了新的思路。
通讯作者与第一作者信息
广医-广州生物院联合生科院张笑人教授为本文通讯作者,中山大学附属第三医院邵春奎教授和广州医科大学李卫教授为共同通讯作者。广州医科大学博士后刘丹丹博士为本文第一作者,原广州医科大学博士后张浩浩博士与中山大学附属第三医院张一望博士为本文的共同第一作者。研究团队还包括多名共同作者,他们在实验设计、数据分析和论文撰写中做出了重要贡献。本项工作得到了时玉舫教授、刘永忠教授、侯英勇教授、诸江教授的支持与指导。
